Este artículo resultará de utilidad para los apasionados de la química, entre los cuales me encuentro, que no tienen una visión global del funcionamiento de una refinería y de la manera en que los reactores trabajan dentro de una unidad de refino de petróleo.
En buena parte de las unidades de producción que forman parte de una refinería de petróleo se producen reacciones químicas sucesivas a lo largo de todo el proceso de refinado que son necesarias para la correcta formación del producto final. La imagen de abajo está sacada de Wikipedia y corresponde a un diagrama básico de la configuración típica de una refinería de petróleo que nos servirá para el propósito de este artículo.
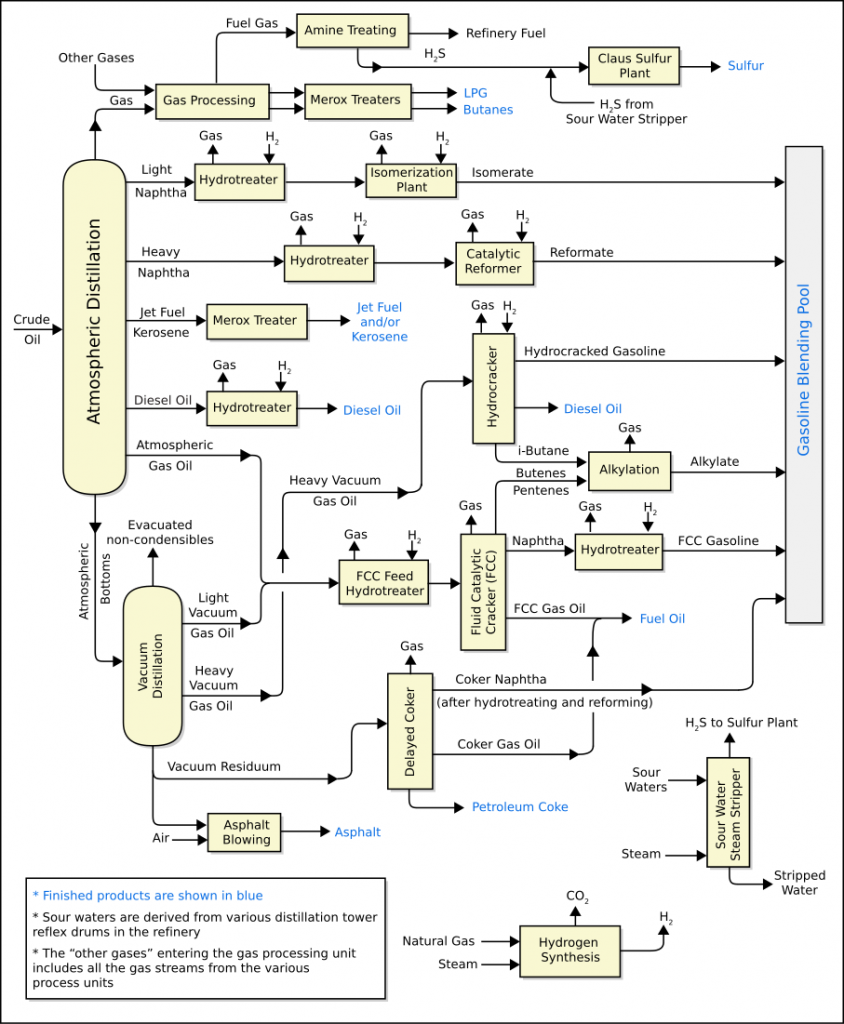
Algunas de estas reacciones tienen como objetivo la eliminación de algún componente perjudicial para los equipos que forman parte del proceso o para el cliente final, como es el caso de la ud de HDS (hidrotratamiento de azufre) que elimina el azufre contenido en los productos resultantes de la destilación del crudo, o la ud de recuperación de azufre, más conocida por sus siglas en inglés Sulfur Recovery Unit o SRU, donde tiene lugar la reacción de Claus para separar el azufre del SH2, cuyo funcionamiento explicaremos en futuras publicaciones.
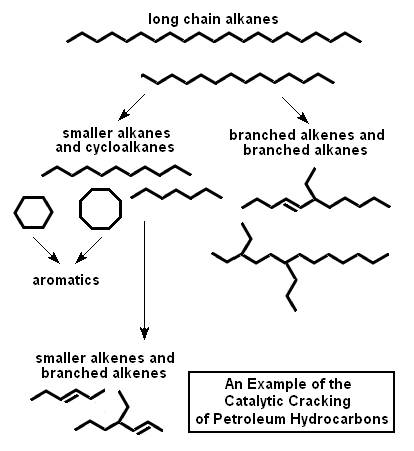
En cambio, en otras unidades de producción como las de FCC o Hidrocraker, las reacciones que tienen lugar están diseñadas para el craqueo o división de las cadenas moleculares más pesadas, productos de la destilación del crudo, en otras más ligeras y apropiadas para la mezcla final de las gasolinas o diésel, con números de octano y cetano mayores.
La mayoría de estas reacciones, dado que tienen lugar en presencia de catalizadores que aceleran las mismas, están patentadas por los fabricantes de dichos catalizadores o por algunas de las petroleras más importantes por lo que, tanto las ecuaciones generales como las reacciones secundarias que tienen lugar con el catalizador, no son publicadas y por tanto, los trabajos de ingeniería de procesos en los que intervienen reactores no suelen externalizarse por las compañías petroleras, sin embargo, el patrón secuencial que se sigue en todas ellas es el mismo: Mezcla de los reactivos, Precalentamiento de los mismos, Reacciones entre los reactivos, productos y catalizador para producir el craqueado, Destilación posterior con enfriamiento y envío a otra unidad de tratamiento o a blending. A continuación desarrollaremos una breve descripción de las tres primeras, dejando la Destilación o Fraccionamiento para artículos futuros.
MEZCLA DE REACTIVOS.
En buena parte de las reacciones producidas en una refinería interviene el Hidrógeno para sustituir algún elemento que se quiere separar de las moléculas de hidrocarburo, por ejemplo el azufre en las reacciones producidas en la unidad HDS, o para reponer algún enlace de carbono roto durante el craqueo de las cadenas largas de hidrocarburos saturados (parafinas o naftenos) o insaturados (olefinas o aromáticos). Por tanto, el aporte de H2 es fundamental y es por ello necesario un cálculo previo de la cantidad de moles de H2 que serán necesarios que intervengan en la reacción, así como su mezcla adecuada con otros gases como metano, etano, propano y butano, debido a las dificultades que presentaría para el mantenimiento y seguridad de la planta la gestión de un porcentaje elevado de hidrógeno puro. Este cálculo se conoce como Make-up de H2 y sirve para establecer el caudal de H2 apropiado para mezclar con el hidrocarburo que va a ser craqueado o tratado.
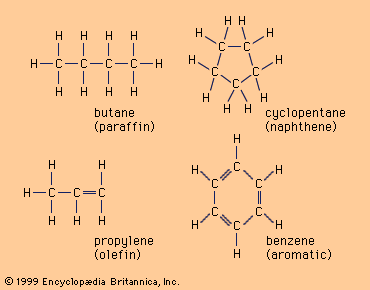
https://www.britannica.com/technology/petroleum-refining/Saturated-molecules
Llegados a este punto, es importante señalar que lo que llamamos hidrocarburo, no es un único producto sino que se compone de una mezcla de distintos componentes como los representados en la imagen de arriba, con longitudes de cadena variables, las cuales van a ser divididas en otras de longitudes más cortas más apropiadas para su comercialización como combustible para transporte, por lo que el producto resultante del craqueo realizado en el reactor, posteriormente debe ser fraccionado para separar los distintos productos producidos en función de sus propiedades comerciales: los más ligeros formarán parte del blending de gasolinas y los más pesados para diésel.
PRECALENTAMIENTO DE REACTIVOS.
Las reacciones químicas, tanto las exotérmicas como las endotérmicas, necesitan un aporte de energía para su inicialización. A esta energía se la conoce como energía de activación, o por sus siglas Ead (energía de activación de la reacción directa) o Eai (energía de activación de la reacción inversa), en una reacción en la que la formación de los productos y los reactivos se encuentra en equilibrio.
El objetivo del precalentamiento es llevar la mezcla de hidrocarburo e H2 a las condiciones de energía de activación necesaria para que comience la reacción en el reactor como se puede apreciar en la imagen siguiente para una reacción típica en equilibrio. La intervención de un catalizador no altera el equilibrio pero si contribuye a reducir la energía de activación necesaria para el comienzo de la reacción, así como a que el equilibrio se alcance antes.
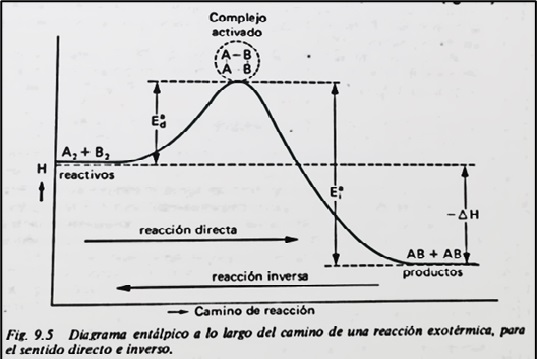
Como se deduce del diagrama se cumple siempre que ∆H = Ead – Eai, donde ∆H es el incremento de entalpía de la reacción y dado que las energías de activación son siempre positivas, se puede concluir que:
∆H < 0 => Ead < Eai => Reacción exotérmica.
∆H > 0 => Ead > Eai => Reacción endotérmica.
En función de la magnitud de la energía de activación directa necesaria para la formación de los productos, el precalentamiento se podría aplicar con intercambiadores de calor carcasa-tubo o mediante hornos de fuelgas o gas natural.
REACCIONES
En función de la naturaleza de los reactivos y de los productos a conseguir en la reacción, los reactores trabajan a unas determinadas condiciones de presión y temperatura a las que tiene lugar la reacción y que vienen condicionadas por la energía de activación aportada en la etapa anterior de precalentamiento, con una constante cinética característica del equilibrio de la reacción, la cual se define como el cociente entre la constante cinética de la reacción directa y la constante cinética de la reacción inversa, según la nomenclatura abajo explicada para una reacción en equilibrio tipo como la siguiente:
a x A + b x B ↔ c x C + d x D donde:
Vd = Velocidad de reacción directa. Mide la variación de las concentraciones de los reactivos con el tiempo = Kd x [A]a x [B]b (suponiendo que se cumple la Ley de masas y los exponentes son iguales a los coeficientes estequiométricos).
Vi = Velocidad de reacción inversa. Mide la variación de las concentraciones de los productos con el tiempo = Ki x [C]c x [D]d (suponiendo que se cumple la Ley de masas y los exponentes son iguales a los coeficientes estequiométricos).
[X] = Concentración de reactivos o productos.
K = Constante cinética de la reacción
Kd = Constante cinética de la reacción directa.
Ki = Constante cinética de la reacción inversa.
Relacionadas de la siguiente manera:
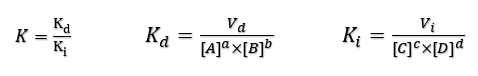
Cuando se alcanza el equilibrio, las velocidades directa e inversa se igualan por lo que podemos hacernos una idea de si el equilibrio está desplazado a la derecha (del lado de los productos) o a la izquierda (del lado de los reactivos) en función del valor de la K descrita anteriormente:
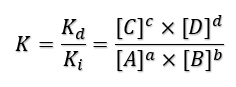
Las constantes cinéticas directas e inversas sólo dependen de la Tª según la ecuación de Arrhenius sin embargo, el equilibrio puede verse desplazado hacia los productos o reactivos en función de la variación de otros 2 parámetros: la presión y la concentración de productos y reactivos.
Para predecir de forma cualitativa la influencia de cada uno de los anteriores factores en el desplazamiento del equilibrio, se utiliza el principio de Le Chatelier que dice: “Cuando en un sistema en equilibrio se varía algún factor externo, el equilibrio se desplaza en el sentido que tienda a contrarrestar dicha variación”. Vamos a describir brevemente la aplicación de este principio a cada uno de los factores mencionados.
Temperatura. En una reacción exotérmica, al enfriar, la reacción debe oponerse al enfriamiento y por tanto, se desplazará hacia la derecha.
En general, puede establecerse que si la reacción directa es exotérmica, al disminuir la Tª aumenta K, es decir, que la reacción se favorece al bajar la Tª. En cambio, si la reacción es endotérmica, al aumentar la Tª aumenta K y se favorece la reacción.
La aplicación directa de este principio se puede observar en algunos reactores instalados en las unidades de refino, en los cuales, al ser la reacción exotérmica y no poder evacuar a través de la paredes del reactor el calor producido en la reacción, este eleva la Tª de la reacción, haciendo desplazarse el equilibrio hacia la izquierda, siendo necesario para reestablecer el mismo el enfriamiento de los productos de la reacción, lo cual se consigue mediante un sistema conocido como “quenching”, que consiste en inyectar una parte de la corriente que sale por el fondo del reactor, previamente enfriada, en la salida del lecho del catalizador del reactor, con lo cual se podría conseguir la completa transformación de los reactivos que entran al reactor.
Presión. La presión sólo influye prácticamente en las reacciones entre gases (o por lo menos con una sustancia gaseosa).
Al aumentar la presión total, el equilibrio se desplaza en el sentido en que disminuye el volumen, es decir, hacia la izquierda, con lo que tiende a contrarrestar el efecto externo.
Como el volumen de un gas es proporcional al nº de moles, al aumentar la presión se favorecerá la reacción en el sentido en que disminuya el nº de moles. Por tanto, en las reacciones que tienen lugar sin variación en el nº de moles, la presión total no afecta al equilibrio.
La aplicación directa de este principio la podemos observar en la operación de drenado del fondo de una esfera gas (butano o propano por ejemplo). Aunque no se trata de una reacción propiamente dicha, sino de un equilibrio con cambio de fase, nos puede servir para ilustrar este principio.
Cuando se abre la válvula del fondo, el volumen superior ocupado por el gas aumenta conforme se va vaciando la esfera de líquido, por lo que para restablecer el equilibrio, según el principio de Le Chatelier, aumentará el nº de moles de gas en equilibrio a la Tª ambiente en que se encuentre la esfera, con lo cual, al terminar la operación de drenado, la presión volverá a restablecerse con un mayor nº de moles de gas ocupando el espacio superior de la esfera.
Veamos otro ejemplo con una reacción típica en la que se cumple la Ley de masas y por tanto, podemos utilizar los coeficientes estequiométricos como exponentes de las concentraciones. Se trata de la reacción endotérmica de dimerización del dióxido de nitrógeno:
N2O4 (g) ↔ 2NO2 (g) ∆H = + 57 kj/mol donde
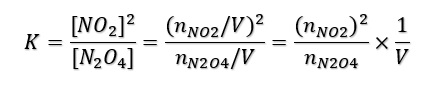
Donde hemos puesto las concentraciones en función del nº de moles, n, y el volumen ocupado por el gas V.
Si en esta reacción aumentáramos la presión reduciendo el volumen, dado que el valor de K no variaría ya que sólo depende de la Tª, el nº de moles del reactivo tendría que aumentar para mantener constante la K, por lo que el equilibrio se desplazaría hacia la izquierda.
Concentración. La variación de la concentración de cualquiera de las sustancias que intervienen en un equilibrio no modifica el valor de la constante de equilibrio, al igual que la variación en la presión, pero sí afecta a las concentraciones de equilibrio de las restantes sustancias.
Aplicando el ejemplo anterior de la esfera de gas, se puede observar que en la operación de venteo, al abrir la válvula de salida del venteo, la concentración de los gases en equilibrio disminuye al disminuir el nº de moles manteniéndose el volumen superior constante. Según el principio de Le Chatelier, el sistema reaccionará reponiendo el equilibrio aumentando el nº de moles de gas producidos por vaporización del liquido condensado en el fondo hasta alcanzar la presión inicial de partida con un volumen de líquido menor.